25. lecke
A tanulság 25 „sók” természetesen „Chemistry kezdőknek” megtanulják, hogyan kell helyesen hívja sók, azok összetételét és megtanulják, hogy a kémiai képletek sók.

Amint azt az előző leckében savak reakciókban a megfelelő egyszerű fémmel felszabaduló hidrogén-H2. Emellett hidrogénatom, szintén kialakult komplex anyagok: ZnCl2. . MgSO 4, stb Ezek képviselői az osztály közös a kémiában a vegyületek - só (102 ábra.).

Itt nézd meg a készítmény sókat, megtanulják, hogy a képletek, tudja, hogyan kell hívni a sót.
Összetétel sók
Összehasonlítása képletű savak sósav és H2 SO4 c képletek ZnCl2 és FeSO4 sói. Látjuk, hogy ezekben a képletekben azonosak anionok Cl (I), és SO4 (II). De-molekulák is csatlakozik a hidrogénatomok H, és a sók definiálható egységek - a Zn és Fe vas cinkatom. Ennélfogva, ezen és más sói lehet tekinteni, mint helyettesítő termékek a hidrogénatomok a molekulák a savak fémek atom. Anyagok, mint a ZnCl2 és FeSO4. csoportjába tartozik, a sók.
Sók - összetett anyagok alkotják fématomok és savas maradékok.
A sók a savas maradékok kötődnek fématomok összhangban a vegyértékű. A készítmény a kémiai képlete só szükséges ismerni a vegyértéke a fématom és a vegyérték a sav rész. Így használja ugyanazt a szabályt, mint a vegyületek előállítására képletek bináris. A sók általában az alábbiak szerint: az összeg az összes egység a fém vegyértékével atomok egyenlőnek kell lennie az összeg az összes egység vegyértékű-maradék.
Például, a só formula, amely magában foglalja a kalcium-atom és a sav foszforsav maradék PO4 (III). Kalcium mutatja állandó vegyérték II, valamint a vegyérték a sav maradék PO4 III.

nevek sók
Sók, melyeket az atomok különböző fémek és a különböző savas maradékok. Ezért, az összetétele a sók a legkülönbözőbb. Tanuljunk meg nekik a helyes neveket.
Cím sók közé tartoznak a sav maradékot név és a fém a birtokos esetben. Például, a készítmény nátrium-klorid-só az úgynevezett „nátrium-klorid”.
Ha része a képletnek megfelelő egységenként a só fématom olyan variábilis vegyértéke, ez jelzi a római szám után zárójelben a neve. Így, só FeCl3 úgynevezett „vas-klorid (III)», és a sót FeCl2 - «vas-klorid (II)».
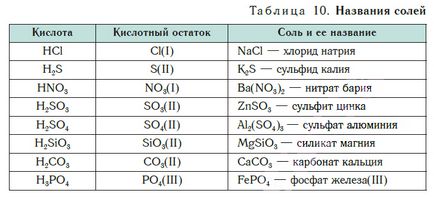
A 10. táblázat a nevét egyes sók.
Salt - nem anyag molekuláris szerkezetére. Ezért, annak összetétele fejezzük képlet segítségével egységek. Ezek tükrözik az arány a fématomok és savas maradékok. Például, a képletnek megfelelő egységenként NaCl atomonként Na van egy savas maradék jelentése klóratom.
Szerint a kémiai képlete só képes kiszámítani saját képletű tömegére vonatkoztatva Mr. és a molekulatömeg M. Például:
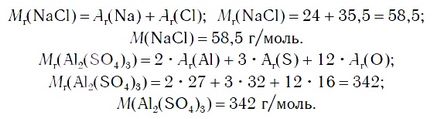
Sók tárgya nemcsak sót (NaCl), de mész, a márvány (CaCO3), nátrium-karbonát (Na 2CO 3), kálium-permanganát (KMnO4), és mások.
Rövid lecke következtetéseket:
- Sók - komplex anyagok, hogy áll atomok fémek és anionok.
- A sókat úgy állítjuk elő, helyettesítve a hidrogénatomok a molekulák a savak fémek atom.
- Salt - nem anyag molekuláris szerkezetére.