Periódusos kémiai elemek Leeuw
A természetben van egy csomó ismétlődő szekvenciák:
- évszak;
- napszak;
- a hét napjai ...
A 19. század közepén, Mendeleev észrevette, hogy a kémiai tulajdonságai elemek is van egy bizonyos sorrendben (mondjuk jött az ötlet, hogy neki álmában). Az eredmény a csodálatos álom a tudós lett a periódusos kémiai elemek, amelyben DI Mengyelejev beépített kémiai elemek növekvő atomtömeg. A modern kémiai táblázat elemei vannak elrendezve növekvő atomszámú (a protonok száma az atommag).
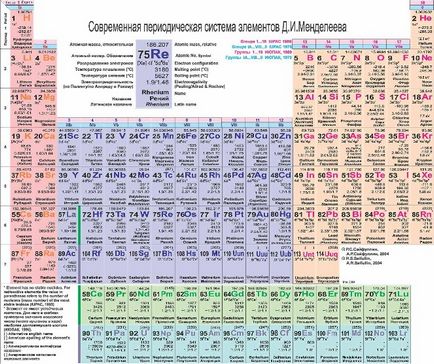
Az atomi szám megjelenik a kémiai szimbólum, jelképe - atomsúly (összege protonok és neutronok). Megjegyezzük, hogy az atomi tömeg az egyes tételek nem egész! Emlékezz izotópok! Atomtömeg - súlyozott átlaga az összes Egy elem izotópjai természetesen előforduló vadon.

A táblázat alatt található a lantanidák és aktinidák.
A vízszintes vonal időszakokban a periódusos rendszer említett.
Időszakok vannak számozva 1-7.
A függőleges oszlopok a periódusos említett csoportok (családok).
Számozás csoportok eredetileg alkalmazott római számokkal és betűkkel (IA, IIA, IIIB ...). Most, hogy leírja csoportok segítségével több 1-18.
1. Fémek, nemfémek, nemfémek
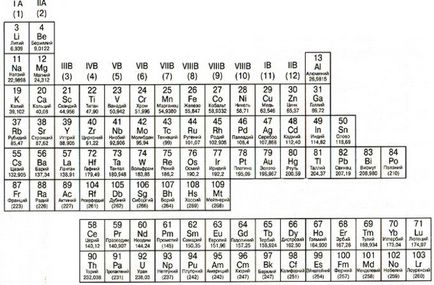
Fémek vannak elrendezve a periódusos bal oldalán lépcsős átlós vonal, amely kezdődik Bora (B) és végződik polónium (Po) (kivéve a germánium (Ge) és antimon (Sb). Könnyen belátható, hogy a fémek foglalják el a legtöbb a periódusos rendszer. A fő tulajdonságai fémek: szilárd (kivéve a higany); fényét, jó villamos és hővezető, műanyag, képlékeny, könnyen adományozni elektronokat.
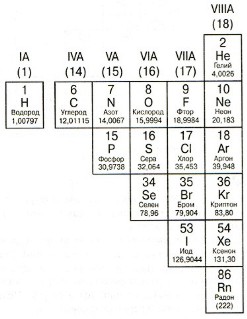
Elemei a jogot a diagonális lépésben B-Po, úgynevezett nem-fémek. Tulajdonságok nem fémek közvetlenül szemben a fém tulajdonságai: rossz vezető hő és a villamos energia; törékeny; merev; nem-műanyag; általában elfogadják elektronokat.
félfémet
félfémek (félfémek) között található fémek és nemfémek. Jellemzőjük a fémek tulajdonságait egyaránt és nem fémek. A fő alkalmazása az iparban félfémek talált a félvezető ipar, amely nélkül a modern chip vagy mikroprocesszor.
2. időszakok és csoportok
Amint a fentiekben említettük, a periódusos rendszer oszlik hét időszakokban. Minden időszakban, a rendszám az elemek növelik balról jobbra.
Tulajdonságai elemek időszakokban változhat szekvenciálisan a nátrium (Na) és magnézium (Mg), elején található a harmadik időszak donate elektronokat (Na ad egy elektron: 1s 2 2s 2 2p 6 3s 1; Mg elveszti két elektron: 1s 2 2s 2 2p 6 3s 2). De klór (Cl), a végén található az időszak, kap egy elem: 1s 2s 2 2 2 2p 6 3s 3p 5.
A tulajdonságok a kémiai elemek belül egy periódus különböző.
A csoportok, éppen ellenkezőleg, az összes elemet ugyanolyan tulajdonságokkal. Például, a IA-csoport (1) az összes elemet a lítium (Li), és befejezve francium (Fr), kap egy elektron. És az elemek mind a csoport VIIA (17) befogadó egyik eleme.
Egyes csoportok annyira fontos, hogy kaptak külön nevet. Ezek a csoportok az alábbiakban tárgyaljuk.
3. Alkálifémek
Csoport IA (1). Az atomok elemek E csoport a külső elektron réteg csak egy elektron, így könnyen adja egy elektron.
A legfontosabb alkálifémek - nátrium (Na) és kálium (K), mert fontos szerepet játszanak az ember életében, és része a sók.
4. Alkáli földfémek
IIA csoport (2). Az atomok elemek E csoport a külső elektronikus réteget két elektron, ami szintén adott során kémiai reakciók. A legfontosabb elem - a kalcium (Ca) - alapján a csontok és a fogak.
5. halogének
Csoport VIIA (17). Az atomok elemek ezen csoport általában úgy állítjuk elő egy elektron, mert a külső elektron réteg van az öt elem, és a „teljes készlet” csak hiányzik egy elektron.
A legismertebb tagjai ennek a csoportnak: klór (Cl) - része a sók és fehérítőt; Jód (I) - olyan elem, amely fontos szerepet játszik az emberi pajzsmirigy.
6. inert (nemes) gáz
Csoport VIII (18). Atomjai elemei a csoportok teljesen „emberes” külső elektron réteg. Ezért ezek a „nem” fogadja elektronokat. És ad nekik, amit „nem akarnak”. Ezért - az elemek ebben a csoportban nagyon „vonakodva” lép kémiai reakciók. Sokáig azt hitték, hogy ezek általában nem reagálnak (innen a „semleges”, azaz az „inaktív”). De vegyész Neil Bartlett felfedezték, hogy néhány ilyen gázok, bizonyos feltételek mellett, továbbra is reakcióba más elemekkel.
- Ne - 1s 2s 2 2 2p 6;
- Ar - 1s 2s 2 2 2 2p 6 3s 3p 6;
- Kr - 1s 2s 2 2 2p 6 3s 3p 2 6 2 4s 3d 4p 10 6
7. A stretching csoportbeli elem
Könnyen belátható, hogy az egyes csoportokon belül az elemek egymáshoz hasonló azok vegyérték elektronok (elektronok s és p-pályák elhelyezve a külső energia szinten).
Az alkálifém - 1 vegyérték-elektron:
A alkáliföldfémek - 2 vegyérték elektronok:
A halogének - 7 vegyérték elektronok:
- F - 1s februári február 2 2 p 5;
- Cl - 1s 2s 2 2 2p március 6 március 2 s p 5;
- Br - 1s 2s 2 2 2 2p 6 3s 3p június 4 s 2 p 3d április 10 5
At inert anyag - 8 vegyérték elektronok:
- Ne - 1s februári február 2 2 p 6;
- Ar - 1s 2s 2 2 2p 6 March March 2 s p 6;
- Kr - 1s 2s 2 2 2 2p 6 3s 3p június 4 s 2 p 3d április 10 6
Római oszlop száma a csoport - az a szám, vegyérték elektronok minden csoport elemeit.
Térjünk most viszont a figyelmet, hogy az elrendezett csoportokban karakterek B. Ezek található a központtól a periódusos nevezzük átmeneti fémek.
A megkülönböztető jellemzője ezeknek elemek jelenléte az elektronok az atomok, töltőanyag d-pályák:
- Sc - 1s 2s 2 2 2 2p 6 3s 3p 6 4S 2 3d 1;
- Ti - 1s 2s 2 2 2 2p 6 3s 3p 6 4s 2 3d 2
Eltekintve az alapvető táblázatban lantanidák és az aktinidák - egy úgynevezett belső átmeneti fémek. A atomok ezen elemek elektronok töltse F-pályák:
- Ce - 1s 2s 2 2 2 2p 6 3s 3p 6 4S 2 4p 6 3d 10 4d 10 5s 5p 2 4f 6 5d 1 1 6s 2;
- Th - 1s 2s 2 2 2 2p 6 3s 3p 6 4S 2 4p 6 3d 10 4d 10 5s 5p 2 4f 6 5d 14 10 6S 2 6p 6 6d 2 7s 2