A lényege a periódusos - Chemistry dummies nulláról, az alapjait a kémia, himi4ka
Még az iskolában, ül a kémia órákon, mindannyian emlékezni egy tábla a falon egy osztály vagy egy kémiai laboratóriumban. Az alábbi táblázat tartalmazza besorolás összes ismert kémiai elemek az emberiség, az alapvető összetevők alkotják a Föld és az egész univerzumot. Akkor nem tudtuk úgy gondolja, hogy a periódusos rendszer kétségtelenül az egyik legnagyobb tudományos felfedezés, amely az alapja a modern ismeretek kémia.
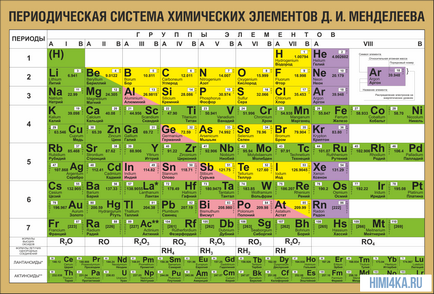
Első pillantásra az ő ötlete megtévesztően egyszerű: gondoskodjon elemek sorrendjében növekvő súlya az atomok. Sőt, a legtöbb esetben úgy tűnik, hogy a kémiai és fizikai tulajdonságai az egyes elemek hasonlóak az előző elem az asztalához. Ez a minta nyilvánvaló mindenki számára megfelelő terméket, kivéve néhány legelső, egyszerűen azért, mert nincs előtte hasonló elemekből atomi tömeg. Ez köszönhető a felfedezése egy ilyen tulajdonság tudunk lineáris elemek sorozatát a táblázatban, nagyon hasonlít egy fal naptár, és így, hogy összekapcsolják egy hatalmas különféle kémiai elemek egy világos és koherens formában. Persze, ma fogalmát használják a rendszám (a protonok száma) ésszerűsítése érdekében a rendszer elemeit. Ez segített megoldani az úgynevezett technikai probléma „egy pár permutációk”, de nem vezetett alapvető változás formájában periódusos rendszerben.
Az összes elemet a periódusos vannak összhangban elrendelt atomszámukon, elektronszerkezet és ismétlődő kémiai tulajdonságok. A táblázat sorai a nevezett időszakok és oszlopok csoportban. Az első táblázatban nyúlik vissza, a 1869-es év, amely összesen 60 elemet, most az asztal kellett növelni, hogy a 118 elem a ma ismert.

A tulajdonságok a periódusos táblázat
A periódusos rendszer elrendezi nemcsak az elemek, hanem a legkülönbözőbb tulajdonságokat. Vegyész gyakran elég ahhoz, hogy a szemem előtt a periódusos rendszer, annak érdekében, hogy helyesen válaszolni egy csomó kérdést (nem csak a vizsga, hanem a tudományos).

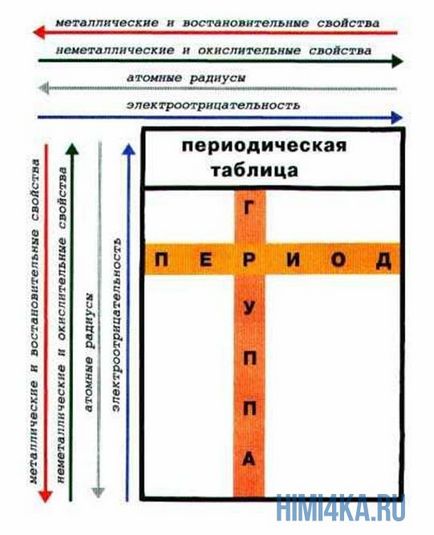
Nézzük újra a periódusos rendszer. Amellett, hogy a mély alapvető kapcsolat az elemek között, tükrözi számos hasznos a tanulmány a kémiai törvényekkel.
Periódus - a vízszintes vonalak a kémiai elemek.
Csoportok - függőleges oszlopokban a kémiai elemek.
Alcsoport - A - fő (s- és p-komponensek) és a - oldali (D- és F-elemek).
időszaknak a számát - a külső energia szinten az elektronikus elem a képlet atom.
csoport száma (a legtöbb elemek) - a teljes száma vegyérték elektronok (elektronok a külső réteg, valamint az utolsó előtti al d-, ha nem épül fel teljesen).
A tételek száma az időszakban - a maximális kapacitása a kapcsolódó energetikai szint:
1 ciklus - 2 elemek (1 S 2)
Időszak 2-8 elemek (2s 2 2p 6)
Időszak 3-8 elemek (3s 3p 2 6)
4 időszak - 18 elemek (4S 2 4p 10 6 3d)
Között 5-18 elemek (5S 5p 2 10 4d 6)
6 időszak - 32 elemek (6s 2 4f 14 10 5d 6p 6)
7. időszakban nem teljes -
A építési időszak - az elején: két S-elem, a végén hat p-elemek. A negyedik és ötödik időszakok közötti görcsök tíz d-elemeket, és a hatodik és hetedik adunk nekik tizennégy F-elemek (formái elektron pályák).
Az az időszak - tulajdonságai kémiai elemek különböznek egymástól, mivel az elektronikus konfiguráció a vegyérték elektronok az atomok különböző.
Egy alcsoport - tulajdonságai az elemek hasonlóak egymáshoz, mivel az elektronikus konfiguráció a vegyérték elektronok az atomok hasonlóak. Ennek oka az a periodicitás tulajdonságainak kémiai elemek a periódusos kiújulásának hasonló elektronikus konfigurációk külső energia szintek.
BESOROLÁS kémiai elemek tulajdonságok
Alkáli- és alkáliföldfémek
Ezek közé tartozik elemeit az első és a második csoport, a periódusos rendszer. A alkálifémek az első csoport - egy puha fémből, ezüst, jól késsel. Ezek mindegyike egyetlen elektron a külső héj és tökéletesen reagál. Alkáliföldfémek a második csoport is van egy ezüst színű. Külsőleg elhelyezett két elektron, és ennek megfelelően, ezek a fémek kevésbé valószínű, hogy kölcsönhatásba más elemekkel. Összehasonlítva alkálifémek, alkáliföldfémek megolvasztjuk és forraljuk magasabb hőmérsékleten.