Salt - kémiai enciklopédia
SALT. olyan kémiai. vegyületek. Általánosan elfogadott definíciója a „sók”, valamint a „sav és bázis”, termékek a kölcsönhatás. to-ryh só jelenleg nem létezik. A sók tekinthetők helyettesítő termékek hidrogén protonok a-hogy az fémionok, és más kationokkal vagy OH-csoportok a bázis anionok-t (például Cl - ,.) .. Helyettesítés termékek teljes közegben sók, pl. Na 2SO 4. MgCl2. hiányos - savas vagy bázikus só, pl. KHSO4. CuClOH. Különbséget is egyszerű sót, amely egy típusú kationt és egy faj anionok (pl. Nátrium-klorid), egy kettős só, amely két típusú kationokat [pl. KAl (SO4) 2 · 12H2 O], vegyes sók a készítményben, hogy két-ryh-maradék (pl. AgClBr). Komplex sók (lásd. A koordinációs vegyület) tartalmaznak komplex ionok. pl. K4 [Fe (CN) 6]. T. nevű. belső sókat, pl. Betain (CH3) 3 NCH2COO -. bipoláris ionok.
Tipikus sók -kristallich. Szigeteknek az ion szerkezet, pl. CSF (lásd. Az ionos kötéssel. Az ionos kristályok). Vannak is kovalens sók, pl. A1Sl3 (lásd. A kovalens kristályok). Tény, hogy a természet a kémiai. Közötti kommunikáció számos só - Vegyes. A szabályok formájában sók nevek utalnak. A kémiai nevezéktan.
A p-rimosti megkülönböztetni oldódik vízben, gyengén oldható, és lényegében oldhatatlan sókat. Ahhoz, hogy p - oldható közé tartozik szinte az összes nátrium-só. kálium- és ammónium. pl. nitrátok. acetát és kloridok. azzal az eltéréssel, többértékű fém-sók. hidrolízis vízben. pl. sav-só.
A vizes p-PAX-só teljesen vagy részlegesen disszociál ionokra (lásd. Elektrolitos disszociáció). Sói gyenge-t, és (vagy) vetjük alá, hogy gyenge bázisok a hidrolízis. Víz sói p-ry tartalmaznak hidratált. ionok (lásd. hidratáció), ionpárok és bonyolultabb kémiai. formák, beleértve a hidrolízis-termékek, és mások. A számú só szol. is alkoholokban. aceton. amidok k-m et al., Org. p-celeration.
Vizes só p-árok kristályosodásra kristályos formában (lásd. Hidrátok) egy nemvizes-kristály szolvátjai. pl. SaVr2 H5 OH · 3c2 (lásd. A szolvátok). P-ry kölcsönhatás sók. fémekkel. Standardpotenciál to-ryh negatívabb, mint a potenciális a fém. része a só:
Mivel a p-jól oldható sói gyenge erős over-t-te, hogy kiszorítsa gyengébb:
Mivel a p-jól oldódó sói gyenge bázisok erősebb p-bázis-oldható kiszorítják gyengébb:
A vizes rendszerekben, a só léphet fel a sók cseréjét p-TION, feldolgozza gyengén oldódó sók vagy komplexek:
Adatok december A folyamatok előforduló vizes-só rendszerekben a p-rimosti sók azok közös jelenléte, attól függően, hogy m-séklet, nyomás, és a koncentráció. az összetétele a szilárd és folyékony fázist, m. b. kapott tanulmányozása diagramok rimosti p-víz-só rendszerek (1. ábra, 2.,., lásd még oldatok fizikokémiai elemzése ..).
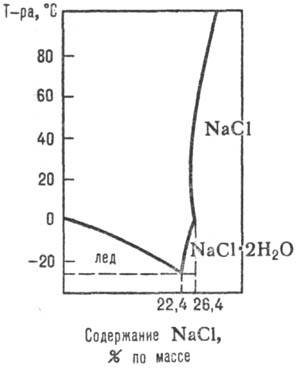
Ábra. 1. ábra p-rimosti rendszerek NaCl-H2 O.
Szintézisének általános módszerét sók. Kölcsönhatást. k-m és bázis (p-CIÓ semlegesítés ur-1.), és a to-t, hogy az alap-oxidok (2) és a bázisok savas oxidok (3), vagy a savas és bázikus oxidok (4):
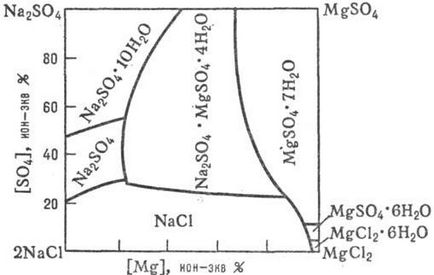
Ábra. 2. ábra p-rimosti "tenger" rendszer 2NaCl + MgSO4 MgCl2 + Na 2SO 4 vízben, 25 ° C-on
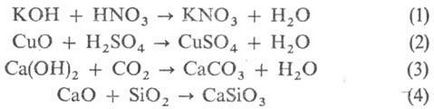
Meg kell jegyezni, hogy az interakciós termékeket. bázisok és a Lewis-t (cm. savak és bázisok) különböznek a szokásos sók velük kapcsolatban használt referenciák. „Sav-bázis komplex”, vagy „addukt”. A kicserélődési kölcsönhatás. közötti k-adik és a só vagy bázikus sóját és (5.6):
A nyersanyag a prom. megszerzése számos-klorid-sókat, szulfátok. karbonátok. borátok Na, K, Ca, Mg a tengeri és óceáni. a víz. o. sóoldatokban, alakult, amikor a víz elpárolog. és szilárd lerakódások sók (lásd. Galurgiya). A csoport az ásványi anyagok. amely egy üledékes só (szulfátok és kloridok Na, K és Mg), feltételes címei alkalmazandó. „Természetes só”. Naib. Nagy betétek kálium sók Magyarországon (Szolikamszk), Kanada és Németország erős betétek foszfát érc, Észak-Afrikában, Magyarországon és Kazahsztán, NaNO3 -B Chile.
Sók használt pishch. Chem. kohászati. üveg, bőr, textil prom-sti, másodpercben. X-ve, az orvostudomány és így tovább. d.
Irod Posin M. E. Technology ásványi sók, 4th ed. 1 -2 H, L. 1974 .; Batsanov SS Kísérleti Foundations Szerkezeti Kémia. M. 1986 o. 195-226; Ksenzenko VI Kononova G. N. elméleti alapjai folyamatainak nyersanyagok feldolgozása halurgy, M. 1982 o. 11-211. VP Danilov.
