Számítások A vizes oldatokat készíthetünk, a
Hozzávetőleges megoldásokat. Az oldatok előállítása közelítő mennyiségű anyagok, amelyek kell venni erre számított kis pontossággal. Atomsúlyainak az elemek, hogy egyszerűsítse a számítások vehetnek néha felfelé kell kerekíteni egész egységet. Így durva számítva a atomsúlya a vas lehet venni, mint 56 helyett a pontos -55,847; kén - 32 helyett a pontos 32,064, stb ...
Azokat az anyagokat, így közelítő oldatok vagy technochemical mérlegelni a műszaki egyensúlyt.
Alapvetően számításokat olyan oldatok előállítására, azonos minden anyag.
A mennyiségét az oldat elkészítése vagy tömegegységben kifejezve (g kg), vagy egység térfogata (ml, n), és minden egyes ilyen esetben, összegének kiszámítására oldott különbözően hajtjuk végre.
Példa. Tegyük fel, hogy van szükség, hogy készítsen 1,5 kg 15% -os nátrium-klorid-oldattal; előre kiszámítja a szükséges Tartozékok Mennyiség-CIÓ sója. Számítás szerint végezzük az arány:
t. e., amikor 100 g oldat 15 g sót (15%), hogy mennyit kell készítenie oldatot 1500 g?
A számítások azt mutatják, hogy szükség van, hogy mérjük 225 gramm só, majd a vizet iuzhio 1500-225 = 1275 |
Ha beállítva, így 1,5 liter azonos oldat, ebben az esetben, a könyvtár ismeri annak sűrűsége megszorozzák az utolsó előre meghatározott térfogatú, és így súly a szükséges mennyiségű oldatot. Így, a sűrűség -noro 15% -os nátrium-klorid-oldattal 15 0C egyenlő 1,184 g / cm3. Így, 1500 ml
Következésképpen, a mennyisége az anyag előállítására 1,5 kg és 1,5 liter oldat változik.
A számítás áraink csak előállítására alkalmazható vízmentes oldatok anyagok. Ha hogy egy vizet só, például Na2SO4-IOH2O1 a számítás módosított valamelyest, mivel ez szükséges figyelembe venni a kristályvizet.
Példa. Tegyük fel kell készülni 2 kg 10% Na2SO4 oldattal, alapuló Na2SO4 * 10H2O.
A molekulatömeg 142,041 Na2SO4, Na2SO4 * 10H2O egy 322,195, 322,20, vagy lekerekített.
Számítás először pas vízmentes só:
Következésképpen, szükség van, hogy a 200 g vízmentes só. Száma dekahidrát sók találhatók a számítás:
Mivel a megoldás nem mindig készült konverzióval a vízmentes só a címkén, ami szükségszerűen kell ragaszkodni az edényt a megoldás, szükséges meghatározni, amelyből a sót oldatot készítettünk, például 10% Na2SO4 oldat vagy egy 25% -os Na2SO4 * 10H2O.
Gyakran előfordul, hogy az előzőleg elkészített oldatot hígítani kell, azaz, hogy csökkentsék annak koncentrációja ..; hígított oldatok vagy térfogat vagy tömeg.
Most már számítani, hogy mennyi, hogy 20% * futam teremt, így 2 liter 5% -os oldat.
A kapott oldatot lehet számítani a tömeg a térfogatának. Ehhez az oldathoz tömeg, osztva a sűrűsége (sűrűsége 20% -os oldat 1,1149 g / cm3), t. E.
Ha a hígító által végzett tömeg, a számítás egyszerűsödik. De általában hígítás végzik a kötet, mint a folyadék, különösen nagy mennyiségben, könnyebb mérni a mennyiséget tekintve, mint a tömeg.
Emlékeznünk kell, hogy minden munkát, mint az oldódás és a hígító soha ne öntse egyszerre az összes vizet az edénybe. Többször átöblítjük vízzel az edényeket, amelyet végeztek súlyméréssel vagy adagoló a kívánt anyagot, és minden alkalommal, a vizet adunk az edénybe oldatot.
Ha nincs szükség speciális precíziós megoldások a hígítás után, vagy összekeverjük oldatokat kapjunk különböző koncentrációjú az alábbi egyszerű és gyors módon.
Vegyük a már elemzett hígítás 20% -os ammónium-szulfát-oldattal és 5%. Írásban az elején az alábbiak szerint:
ahol 20 - oldatot vett koncentráció 0 - Víz és 5 „- a kívánt koncentrációra. Most kivonni 20-től 5 és írd a kapott érték a jobb alsó sarkában levonjuk a zéró 5 írd számjegy a jobb felső sarokban. Ezután a rendszer fog kinézni:
Ez azt jelenti, hogy szükséges, hogy 5 térfogatrész 20% -os oldat és 15 térfogatrész vizet. Természetesen ez a számítás nem különbözik pontossággal.
Ha két oldatot egy és ugyanaz az anyag, az áramkör is fennáll ugyanaz, a változó csak numerikus értékeket. Legyen összekeverjük 35% -os oldat, és 15% -os elkészítéséhez szükséges 25% -os oldat. Ezután a rendszer fog kinézni:
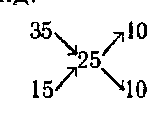
t. e. kell venni, hogy 10 térfogatrész a két oldatot. Ez a rendszer hozzávetőleges eredmények és csak akkor használható, ha különleges pontosság nem trebuetsya.Dlya minden kémikus nagyon fontos, hogy művelni szokott pontossággal számítások ha szükséges, és a közelítő szám abban az esetben, ha ez nem befolyásolja az eredményeket raboty.Kogda több kell pontossággal egy híg oldatban, az kiszámítását végzik képletek.
Nézzük néhány fontos ügyben.
Előállítása híg oldat. Legyen c - az oldat mennyiségét, m% -koncentráció oldatot, amelyeket hígítani kell koncentrációra n%. Ahol a kapott híg oldatot x mennyiség kiszámítása a képlet:
és a víz hígítási V térfogata az oldatot képlettel számítottuk ki:
Elegyítve a két oldatot azonos anyagok különböző koncentrációkban, hogy a kívánt koncentrációjú oldatot. Legyen keverő alkatrészek és m% -os oldatot x tömegrész N% -os oldat előállításához szükséges /% - oldatot ezután:
Pontos megoldásokat. Az oldatok előállítása, a pontos kiszámítása ellenőrzés mennyiségű kívánt anyagok kellő pontossággal. Atomic egyensúly vett elemek a táblázatban, ami azt mutatja, a pontos értékeket. Ha összeadjuk (vagy kivonásával) pontos kifejezés értéke a legkisebb számú tizedesjegy. A fennmaradó feltételek vannak kerekítve, így a tizedesvessző után egy jel több, mint a kifejezés a legkisebb karakterek száma. Ennek eredményeként sokan hagyják tizedesjegyig mint ahány a távon a legkisebb számú tizedesjegy; ugyanakkor a szükséges kerekítés. Minden számítást végeztünk logaritmusok ötjegyű vagy négyjegyű. A számított mennyiségű anyag kimérjük csak analitikai mérlegen.
Súlyozás végzik, vagy óraüvegre, vagy egy mérőüvegbe. Pour a lemért anyagot mossuk tiszta mérőlombikban egy tiszta, száraz, tölcsér kis részletekben. Ezután, egy vízzel többször kis adagokban vízzel mossuk át a tölcsérbe bnzhe vagy homokóra, amelyeket lemérünk. Visszük, és desztillált vízzel mossuk a lemosó többször.
A oversleeping szilárd kristályok vagy porok mérőlombikban nagyon kényelmes használni a tölcsér ábrán látható. 349. Az ilyen tölcsér gyártott konténer 3, 6, és 10 cm3. Lehet közvetlenül lemért mintáját ezen tölcsérek (nem abszorbens anyagot) előzőleg meghatározzuk tömegük. Linkage a tölcsér nagyon könnyen átalakítható mérőlombikba. Amikor lemért öntsük, tölcsért eltávolítása nélkül a nyaka a lombik jól mossuk desztillált vízzel egy mosópalack.
Általában, az oldatok és a pontos fordítás az oldott anyag az oldószerben mérőlombikba (például víz) nem tart tovább, mint a fele a lombik kapacitás. Lezárt lombikban rázatjuk, amíg annak teljes feloldódását a szilárd. Ezt követően a kapott oldatot kiegészítjük vízzel a jelig, és alaposan összekeverjük.
Moláris megoldásokat. 1 liter elkészítéséhez 1 mólos Egy anyag lemérjük analitikai mérleg és 1 mól feloldottuk a fent leírt módon.
Példa. 1 liter elkészítéséhez 1 M ezüst-nitrát oldat radioaktivitását egy táblázat vagy egy molekulatömege AgNO3, ez egyenlő 169,875. A sót kimérjük és vízben feloldjuk.
Ha szükség van, hogy készítsen egy hígabb oldatot (0,1 vagy 0,01 M), lemérjük, 0,1 vagy 0,01 mól sóra.
Ha szükség van, hogy készítsen 1 liter oldatot, kevesebb majd feloldjuk rendre egy minimális mennyiségű sós víz képernyő megfelelő.
Normál oldatokat hasonlóképpen állítjuk elő, nem csak otveshivaya 1 mól és 1 grammekvivalens szilárd anyag formájában.
Amikor a keverés vagy seminormal decinormal oldatban vesszük, 0,5 vagy 0,1 g-ekvivalens. Amikor nem készít 1 liter oldat, és kevésbé, mint például a 100 vagy 250 ml-es, majd a berut1 / 10, vagy 1/4 az anyag mennyiségét, amely szükséges a készítmény az I L, és feloldjuk egy megfelelő térfogatú vízzel.
Ábra 349. csatornákat oversleeping és a minta lombikba.
Miután elkészítettük annak oldatából, szükséges, hogy ellenőrizze a titrálás megfelelő megoldás egy másik anyaggal ismert normalitás. Az elkészített oldat nem felel meg pontosan a normalitás amely úgy definiálható. Ezekben az esetekben a korrekció néha beadni.
Számítás előállítására titrálószer az analit is Gram-ekvivalens az oldott anyag, a következő képlet segítségével:

Példa. Tegyük fel kell készülni 3 liter kálium-permanganát-oldatot, titere vas 0,0050 g / ml. Gram-megfelelője KMnO4 jelentése 31.61. és Gram-ekvivalens Fe 55.847.
Számított a fenti képlet által:
Standard oldatok. Standard oldatok hívták különböző, jól meghatározott koncentrációban alkalmazott kolorimetria, például oldatok, amely 1 ml 0,1, 0,01, 0,001 mg, és így tovább. D. Oldott.
Továbbá kolorimetriás vizsgálattal, az ilyen oldatok szükség meghatározásához a pH-nefelometriás meghatározás, stb Néha standard oldatok „tárolt, lezárt ampullában, de gyakran kell főzni őket közvetlenül a felhasználás előtt standard oldatok előállíthatók egy térfogata nem több, mint 1 liter, és a cha rés .. - kevesebb. Csak amikor egy nagy fogyasztása standard oldatok állíthatók elő néhány liter belőle, majd a feltétellel, hogy a standard oldat nem tárolható hosszú távon.
Az anyag mennyiségét (grammban) megszerzéséhez szükséges ilyen oldatok alábbi képlettel számítottuk ki:

Példa. Meg kell készíteni standard oldatok CuSO4 • 5H2O kolorimetriás meghatározásához a réz, és 1 ml az első oldat tartalmaz 1 mg réz, a második - 0,1 mg, 0,01 mg, a harmadik, negyedik - 0,001 mg. Kezdetben Készítsen elegendő összeg az első oldatot, mint például a 100 ml.
Ebben az esetben, Mi = 249,68; Asu = 63,54; így, készítéséhez 100 ml oldat, 1 ml, amely tartalmaz 1 mg réz (T = 0,001 g / ml), akkor szükséges, hogy
Egy kimért mintát a sót átvisszük egy mérőlombikba és 100 ml vizet adunk hozzá, hogy a jelet. Egyéb oldatokat úgy készítünk, hogy megfelelő főzött.
Empirikus megoldásokat. A koncentrációja Ezek az oldatok gyakran vannak kifejezve g / l vagy g / ml. A készítmény a megoldások használt empirikus tisztítjuk átkristályosítással anyagok vagy reagensek készség órán át. D. A. vagy x. h.
Példa. Meg kell készíteni 0,5 liter CuSO4 oldatot, amely tartalmazza a Cu 10 mg / ml. Oldatának elkészítéséhez használt CuSO4 • 5H2O.
Számítani, hogy mennyi kell ezt electr./solar előállítására előre meghatározott térfogatú oldatot számít Cu kell bennük. Ahhoz, hogy ez a térfogat van szorozva az előre meghatározott koncentrációban, t. E.
500 * 10 = 5000 mg, vagy 5,0000 g
Ezután, ismerve a molekulatömege a sót, ez számít a kívánt számot:
Egy analitikai mérlegen mérőedényben pontosan lemérünk 19,648 g tiszta sót, ez átalakul egy mérőlombikba 0,5 l. Az oldódási végeztük a fent leírtak szerint.