Periódusos
Periódusos rendszer a kémiai elemek (periódusos rendszer) - osztályozása kémiai elemek. létrehozásáról függőség különböző elemek tulajdonságai az atommag díjat. A rendszer grafikus kifejezése az időszakos törvény. által meghatározott magyar kémikus deionizált Mendeleevym 1869. Eredeti változata alakult D. I. Mendeleevym években 1869-1871, és létrehozta a függőség tulajdonságai elemeit atomi tömeg (korszerű módon, a atomtömeg). Összesen javasolt több száz [1] a kép a periódusos rendszer kiviteli alakoknál (analitikai görbék, asztalok, geometriai alakzatok és így tovább. P.). A jelen kiviteli alaknál, a rendszer feltételezi, hogy a csökkentés elemek egy kétdimenziós táblázat, amelyben minden egyes oszlopban (csoport) meghatározza az alapvető fizikai és kémiai tulajdonságait, és a sorok képviselnek időszakokban. bizonyos mértékig hasonlít egymásra.

A legenda szerint az ötlet a kémiai elemek a rendszer jött a Mengyelejev álmában, de tudjuk, hogy ha egyszer a kérdést, hogy ő fedezte fel a periódusos rendszer, a tudós azt mondta: „túl vagyok rajta, talán húsz évvel a gondolat, és úgy gondolja,: ülés, és hirtelen ... kész. "
Írás kártyák alapvető tulajdonságait az egyes elemek (ami akkoriban ismert 63, amelyek közül az egyik - Didim Di - derült ki a jövőben egy a kettő keveréke újonnan felfedezett elemek prazeodinium és neodímium), Mendeleev kezd többször átrendezni ezeket a kártyákat, hogy egy sor hasonló tulajdonságokkal elemei megegyeznek egymással sorban [3]. A munkát küldtek 1869-ben a tudományos intézmények magyarországi és más országokban, az első változat a rendszer ( „A tapasztalat az az elem, amely a saját atomtömeget kémiai hasonlóság”), amelyekben az elemek kerültek tizenkilenc vízszintes sorokban (a sorok a hasonló elemeket, amelyek már a prototípusok csoportok a modern rendszer), és hat függőleges oszlopok (a prototípusa a jövőbeni időszakokban). 1870-ben godu Mendeleev a „Fundamentals of Chemistry” közzétett változata a második rendszer ( „természetes rendszer elemek”), amelynek a formája ismerős számunkra: vízszintes oszlopok analóg elemeket vált nyolc csoportba függőlegesen elrendezett; hat függőleges oszlopok lett az első kiviteli alak időszakokban kezdetét és végét a alkálifém-halogén. Minden periódus volt osztva két sorozat; foglalt különböző elemek a csoport alakult sorozat alcsoportok.

Cover A füzet „Megpróbálom megérteni a vegyi háború éter”, és a periódusos rendszer alól (Politechnikai Múzeum, Budapest, 1902 kiadás)
A lényeg a Mengyelejev féle felfedezés volt az a tény, hogy a növekvő atomsúlyának kémiai elemek tulajdonságaik nem változnak monoton, de időről időre. Miután egy bizonyos számú különböző tulajdonságainak elrendezett növelésében atomsúly, a tulajdonságok kezdenek, hogy ismételje meg. Például, a nátrium-hasonló a kálium. hasonló fluor- klóratom. és az arany, mint az ezüst és a réz. Természetesen a tulajdonságok nem pontosan megismételni, adunk nekik, és a változás. Több munkáját Mengyelejev munka elődeitől az volt, hogy az alapjait a besorolás az elemek Mengyelejev volt nem egy, hanem két - atomtömeget kémiai hasonlóság. Ahhoz, hogy teljes mértékben tiszteletben periodicitás, Mendeleev vette nagyon merész lépésre javította atomsúlyai bizonyos elemei (pl berillium, indium urán tórium, cérium titán ittrium ......) Több feladott a rendszer ellentétes az elfogadott, míg ábrázolásai a hasonlóság a másik (például tallium. tartották egy alkálifém, ez kerül a harmadik csoport szerint a tényleges maximális vegyértéke), üresen maradt sejteket a táblázatban, ahol kellett volna, hogy nyitva maradjon, amíg az elemek . 1871-ben az e munka alapján Mengyelejev fogalmazott a periodikus törvény. ami végül formában már valamelyest javult.
A tudományos pontosság, a periódusos törvény megerősítette hamarosan: a 1875 -1886 években fedezték gallium (EKA-alumínium), szkandium (ekabor) és germánium (ekasilitsy), melyek Mengyelejev kihasználva a periódusos rendszer megjósolt nemcsak a lehetőségét, hogy ezek megléte, hanem a feltűnő pontosság leírt egy sor olyan fizikai és kémiai tulajdonságait.
A korai XX század, azt találtuk, hogy a frekvencia tulajdonságai megváltoznak elemeket határozza meg nem atomsúlya, és egy nukleáris belépőnyílásának atomi szerkezetét. egyenlő a rendszámú és az elektronok száma, amelyek mentén vannak elosztva a elektronhéjak atomok elem határozza meg annak kémiai tulajdonságait.
Elements 115. és 117. kaptak a nevét Moszkva (Mc) és tennessin (Ts) összhangban a javaslatokat a JINR, és az Oak Ridge National Laboratory, Vanderbilt Egyetem és a Lawrence Livermore National Laboratory az Egyesült Államokban.
A leggyakoribb a 3 formái a periódusos rendszer, „rövid” (rövid időszak), „hosszú” (hosszú-időszak) és a „szuper-hosszú.” Az „Ultra Long” változata minden időszakban veszi át pontosan egy egyenes. A „hosszú” kiviteli alak lantanidák és az aktinidák eltávolítjuk a közös asztalra, hogy az kompaktabb. A „rövid” formáját a felvétel, ezen felül, a negyedik és az azt követő időszakok által elfoglalt 2 sor; szimbólumok az elemek a fő-és al-csoportok széle illeszkedik tekintetében különböző sejtekben. Hidrogén néha helyezzük 7-edik ( „rövid” formában), vagy 17-edik ( „hosszú” forma) csoport táblázat [5] [6].
Az alábbiakban egy hosszabb változat (hosszú ideig forma) által jóváhagyott IUPAC (IUPAC), mint a mag.
Periódusos
A rövid forma az asztalra. beleértve a nyolc csoportok tételek [7]. IUPAC hivatalosan megszüntették 1989-ben. Annak ellenére, hogy az ajánlással, hogy a hosszú forma, rövid formája növekedés motorja továbbra is a nagy számú magyar kézikönyvek és kézikönyvek és ezen időpont után. A modern külföldi szakirodalom rövid forma teljesen kizárjuk, hanem használja a hosszú forma. A helyzet egyes kutatók hivatkoznak többek látszólagos racionális tömörsége a rövid formában az asztalra, valamint a tehetetlenség, sztereotip gondolkodás és nem-érzékelés a modern (nemzetközi) adatok [8].
1970-ben, Teodor Siborg javasolt a kiterjesztett periódusos. Niels Bohr kifejlesztett lépcső (gúla) alakja a periódusos rendszer. Sok más, ritkán vagy nem használják, hanem az eredeti, módon grafikusan megjeleníteni a periódusos törvény [9] [10]. Ma már több száz lehetőség az asztalon, a kutatók azt sugallják, hogy minden új lehetőségeket. [11]
Engedély csoportok
Csoport vagy család - az egyik oszlop a periódusos rendszer. A csoportok általában azzal jellemezhető, egy lényegében periodikus tendencia kifejezett, mint időszakokra vagy blokkok. Modern kvantummechanikai elmélete atomszerkezeti magyarázza csoport egységesítés, hogy az elemek az adott csoporton belül általában hasonló elektronikus konfigurációk saját vegyérték kagyló. [12] Ennek megfelelően, az elemeket, amelyek tartoznak az azonos csoportba hagyományosan hasonló kémiai tulajdonságokkal, és egyértelműen igazolni mintázatának változása tulajdonságok növekvő atomszámú [13]. Azonban néhány területen a táblázat, például - a d-blokk és az F-blokk vízszintes hasonlóság lehet ugyanolyan fontosnak, vagy még több jelentősen expresszálódik, mint a vertikális [14] [15] [16].
Összhangban a nemzetközi rendszer elnevezési csoportok vannak számozva 1-től 18 balról jobbra - a alkálifém, hogy a nemesgáz [17]. Korábban ezek azonosítására használt római számokkal. A gyakorlatban, miután az amerikai római számok jelentette, mint írni egy (Ha a csoport található, a s-p-blokk vagy blokk), vagy B (ha egy csoport volt a d-blokk). Ezután alkalmazott azonosítók felelnek meg az utolsó számjegy a modern numerikus mutatók - például eleme a 4. csoport felel meg a nevét, IVB, és azok, akik már ismert, mint egy csoport 14 - IVA. Egy hasonló rendszert használják Európában, kivéve, hogy a levél egy csoportra utal, míg a tizedik, és - csoportokra, mivel a tizedik bezárólag. Csoportok 8, 9 és 10, sőt, gyakran tekintik egy hármas csoport azonosítót VIII. 1988-ban lépett hatályba az új rendszer jelölése az IUPAC. és a korábbi nevei csoportok használaton kívül. [18]
Néhány ilyen csoportokat hozzárendelte a triviális, nem szisztematikus neve (például „alkáliföldfémek”, „halogén”, stb ...); azonban néhány közülük csak ritkán használják. Csoportok három keresztül tizennegyedik, befogadó, mint nevek nem, és az azonosított, számmal vagy név szerint az első tag ( „titán”, „kobalt”, és így tovább), mert azt mutatják, alacsonyabb fokú hasonlóság egymás között vagy minimális megfelelési függőleges törvényszerűségek [17].
Elemek, amelyek ugyanabban a csoportban általában azt mutatják, bizonyos tendenciák atomrádiusz. ionizációs energia és elektronegativitás. Felülről lefelé a csoporton belül atom sugara növekszik (annál inkább megtöltött energiaszintek, a távolabb a sejtmagban vannak elrendezve vegyérték elektron), és az ionizációs energia csökken (a atom gyengíti, és így, visszavonja elektron könnyebbé válik), valamint a és elektronegativitás (amely viszont, növekedését okozta közötti távolság a vegyérték elektronok és az atommag) [19]. Megtörténjen, azonban kivételek ezek a minták - például a csoportban 11 irányába lefelé elektronegativitási növekszik és nem csökken [20].
időszakok szerkesztése
Időszak - sorban a periódusos rendszer. Bár a csoportok, mint a fent említett, az jellemzi, jelentősebb trendek és minták, van is egy régió, ahol a vízszintes irányban nagyobb jelentősége van, és jelentősebb, mint a függőleges - például, ez vonatkozik a F-blokk, ahol a lantanidák és az aktinidák képeznek két fontos horizontális szekvencia-elemek [ 21].
Időszakon belül az elemek mutatnak bizonyos törvényszerűségek a fent említett három szempontok (atomrádiusz, elektronegativitási, és az ionizációs energia), és az energia a elektron-affinitása. Balról jobbra atomrádiusz jellemzően csökken (annak a ténynek köszönhető, hogy minden egyes következő elem megnöveli a töltött részecskék és a elektronokat vonzzák közelebb a sejtmagba [22]), és az ionizációs energia növekedésével párhuzamosan velük (minél erősebb a kötés, hogy az atom, a tovább energia szükséges elektron elvonás). Megfelelően növekvő elektronegativitási és [19]. Ami a elektron-affinitása, a fémek, a bal oldali részén a táblázat jellemzi alacsonyabb értéke ez az index, és a jobb oldali nemfémek megfelelően nagy - kivéve a nemesgázok [23].
blokkok szerkesztése
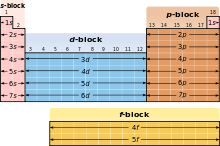
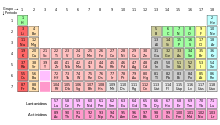
A blokk diagramja, a periódusos rendszer
Tekintettel a fontosságát, hogy a külső elektronsugár héj különböző területein, a periódusos rendszer atom néha le, mint blokkok, említett összhangban a sorrendben, amelynél a héj a utolsó elektron [24]. S-blokk tartalmazza az első két csoport. azaz az alkáli- és alkáliföldfémek, valamint a hidrogén és hélium; p-blokk áll az utolsó hat csoport (13 és 18 szerinti IUPAC elnevezése Standard, illetve IIIA VIIIA az amerikai rendszer), és magában foglalja, többek között más elemek, az összes metalloidok. D-blokk - egy csoport, 3 és 12 (IUPAC), ezek - IIIB-IIB az amerikai, amely tartalmazza az összes átmeneti fémeket. F-blokk. elviselhetővé általában kívül a táblázat, amely a lantanidák és az aktinidák. [25]
Egyéb periodikus mintázatok szerkesztése
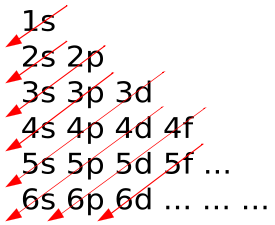
Hozzávetőleges érdekében szabálynak megfelelően Madelung.
A fentiek mellett, az időszakos törvény és megfelelnek bizonyos egyéb jellemzői az elemek:
- Elektronikus konfiguráció. elektronok szervezet bebizonyítja bizonyos időszakonkénti ismétlődő mintát. Az elektronok foglalnak szekvenciát kagyló, amely számokkal azonosítjuk (köpeny 1, a 2 burkolat és a t. D.), és azok, viszont állnak sublevels, által meghatározott betűk s, p, d, f és g. Mivel az atomi elektronok száma fokozatosan töltse ki a burkolat; minden alkalommal, amikor egy elektron vesz egy új shell először, egy új időszak kezdődik az asztalra. Hasonlóságok az elektronikus konfigurációs meghatározzák tulajdonságainak hasonlósága elemek (megfigyelés, hogy valójában, felfedezéséhez vezetett a periodikus törvény) [26] [27].
- Metallicitás / nemetallichnost. Csökkentésével ionizációs energia mutatók elektronegativitási és elektron-affinitása energia elemek megszerezzék a jellemzői a fém, és mivel növelik - éppen ellenkezőleg, a nemfémek [28]. Összhangban a törvények a fent említett jellemzők, a legkifejezettebb fémeket található egy korai időszakban, és nemfémek - a végén. A csoportok másrészt, mint az egyik mozog fentről lefelé fémes tulajdonságok növelik, bár néhány kivétel az általános szabály. A kombináció a vízszintes és függőleges mintázatot ad feltételes közötti választóvonal a fémek és nemfémek lépcsős formában; Ezen a vonalon elemeket néha definiáljuk félfémek [29] [30].

Tulajdonságok elemet. A nyilak jelzik nőtt.
Periódusos DI Mendeleev mérföldkő volt a fejlesztés a atomi-molekuláris elmélet. Ennek köszönhetően a modern koncepció a kémiai elem. Azt finomítva fogalmai egyszerű anyagok, vegyületek.
A prediktív szerepe a periódusos rendszer, ahogy azt a több Mendeleev, a XX században nyilvánult meg az értékelést a kémiai tulajdonságainak transzurán elemek.
Alakult ki a XIX. a kémia tudományát. periódusos elkészült rendezési atomok típusú új ága a fizika. alakultak ki a XX század elején. - a fizika az atom és a nukleáris fizika. A módszerek atomfizikája kutatás, azt találtuk, hogy a sorszám az elem a periódusos rendszerben, más néven számos olyan elemet. (Atomic szám) olyan intézkedés az elektromos töltés a atommag ezen elem, a vízszintes sor száma (időszak) a táblázat határozza meg a számát elektronhéjak atomok. és a szám a függőleges sorban - kvantum szerkezete a felső héj, mely elemek van szükség, és ezt a sorozatot hasonlóságot kémiai tulajdonságait.
A megjelenése a periódusos rendszer és a felfedezés a periodikus törvény nyitott egy új, valóban tudományos korszak történetében a kémia és számos kapcsolódó tudományágak - ahelyett, hogy szétszórt információt az elemek és vegyületek, D. I. Mendeleevym és követői létre harmonikus rendszer alapján, amelyek lehetővé vált általánossá, következtetések levonására, előre látni.