Salt Wikipedia - Wikipédia sók kártya - Információ a Wikipedia a térképen, gulliway
Sók - összetett anyagokat, hogy disszociál fém kationok és anionok a anionok vizes oldatokban. IUPAC definiálja sót mint olyan kémiai vegyületeket álló kationok és anionok. Van egy másik definíció: sói olyan anyagok, amelyek úgy állíthatók elő, hogy a savat és a bázist vízlehasítás.
Továbbá a fém kationok a sók lehetnek ammóniumkationok NH4. .. PH4 foszfónium-származékok és ezek szerves és komplex kationok, stb anionjai sók az anionok az aminosavtól eltérő Johannes Nicolaus Bronsted-savak - a mind szervetlen, mind szerves, beleértve a komplex anionok és karbanionok.
M. V. Lomonoszov műveiben a kémia és a fizika, le a „só”:
sók neve jelzi, rideg testet, amelyek vízben oldódnak, és ez világos marad; nem világít, ha a tiszta tűz hatásának kitett. Ő neme: vitriol és minden más fém só, timsó, bórax, fogkő, jelentős só növények, só, tejszín, fogkő, és a kálium, légy húgysav sója, salétrom, konyhasó tavasz, a tenger és a kő, repülősó, Epsom sót és más sók, amelyek ennek eredményeként a vegyi üzemek.
típusú só
Ha figyelembe vesszük a sót proton helyettesítő termékek savakkal vagy bázisokkal gidroksogrupp, meg tudjuk különböztetni a következő típusú sók:
- Átlagos (normális) só - helyettesítő termékek hidrogén kationok át-molekulák a fém kationok (Na 2CO 3 K3 PO4.).
- Acid sói - a termékek részleges helyettesítés a hidrogén-kation a savakat a fém kationok (NaHCO 3 K 2HPO 4.). Ezek történő semlegesítése útján állítunk a savat feleslegben lévő bázis (azaz hiányzik a bázis vagy sav feleslegét).
- Bázikus sók - helyettesítő termékek tökéletlen gidroksogrupp bázis (OH) savas aminosavak ((CuOH) 2 CO3). Ezek körülmények között alakítjuk a fölös bázis vagy sav-hiány.
Száma szerint, jelen a szerkezet a kationok és anionok a következő típusú sók:
- Egyszerű sók - só, amely egy fajta kationból és egy anion típusa (NaCl)
- Kettős sói - sók, amelyek két különböző kationokkal (KAl (SO4) 2 · 12 H2 O).
- Kevert sók - sók, amely szerkezetben két különböző anion (Ca (OCI) Cl) van jelen.
Megkülönböztetik hidratált sók (kristályos hidrát), amelyek magukban foglalják a molekulákat a kristályvíz, például Na 2SO 4 · 10 H2 O, és a komplex sók. tartalmazó komplex kation vagy komplex anion (K4 [Fe (CN) 6], [Cu (NH3) 4] (OH) 2). Belső sók bipoláris ionok, azaz ezek olyan molekulák, amelyek tartalmaznak mind egy pozitívan töltött, és negatív töltésű atom.
Nómenklatúra sók
Nómenklatúra oxidált sók
Nevek sókat általában társul a nevét a megfelelő savak. Mivel sok savak triviális magyar nyelven, vagy a hagyományos, címek, hasonló neveket (nitrátok, foszfátok, karbonátok, stb) is tárolja és sók.
A hagyományos nevei sók álló anionok nevek a alanyeset és a nevét a kationok a birtokos esetben. Nevei anionok alapján a magyar vagy latin nevét acid elemekkel. Ha a sav-formázó elem lehet egy oxidáció mértéke, ez hozzáadódik a neve utótag -AT:
CO3 - karbonát, GEO3 - germanate.
Ha a sav-formázó elem lehet, hogy két oxidációs állapotban, majd egy anion képződik ez az elem a magasabb oxidációs állapotban, a toldalék -AT használt. és anion elemekkel kisebb oxidációs foka - a toldalék -um:
Ha az elem három oxidációs állapotban, a felső, középső és alsó oxidáció mértéke használnak, rendre utótagjainak -AT. és az utótag -um -um előtaggal hypo -:
Végül, abban az esetben az elemek figyelembe négy oxidációs állapotban magasabb oxidációs prefix használt toll - és utótag -AT. az alábbiakban (a csökkenő oxidációs állapot) utótag -AT. utótag és utótag -um -um előtaggal hypo -:
ClO4 - perklorát ClO3 - klorát, ClO2 - klorit, CIO - hipoklorit.
Előtagok meta -, orto -, poli -, di -, tri -, peroxo - .., stb hagyományosan jelen a nevét savak, is tárolja a nevét anionok.
Nevek nevek kationok megfelelnek az elemek, amelyekből a képződött: adott esetben jelzett atomok száma a kation (. Dirtuti (2+ kation) Hg2 kation tetramyshyaka (2+) AS4) és mértékét az oxidációs, ha ez a változó.
Nevek a savas sókat, hozzáadásával az előtag Hydro - Cím anion. Ha az egyik aniont egynél több hidrogénatom, a feltüntetett összeg segítségével megszorozzuk konzolok (NaHCO 3 - nátrium-hidrogén-karbonát, NaH 2PO 4 - nátrium-dihidrogén-foszfát). Hasonlóképpen, hogy létrehozzák a bázikus sók használt nevek előtagokat hidroxo - ((FeOH) NO3 - gidroksonitrat vas (II)).
Kristályos hidrát adja a nevet hozzáadásával a szót a hagyományos hidrát vagy só szisztematikus neve (Pb (BrO3) 2 · H2 O - hidrátot ólom bromát (II), Na 2CO 3 · 10 H2 O - nátrium-karbonát-dekahidrátot). Ha ismert kristályos szerkezet, a nómenklatúra lehet használni komplex vegyületek ([Be (H2 O) 4] SO4 --szulfát tetraakvaberilliya (II)).
Egyes osztályok sók létező csoport nevét, például timsó - kettős általános típusú MM-szulfátok (SO4) 2 · 12 H2 O, ahol M - kationok a nátrium, kálium, rubídium, cézium, tallium, vagy ammónium, és M - alumínium-kationok, gallium , indium, tallium, titán, vanádium, króm, mangán, vas, kobalt, ródium vagy irídium.
Bonyolultabb vagy ritka alkalmazott sók szisztematikus nevek vannak kialakítva szabályai szerint a nómenklatúra a komplex vegyületek. Ezen nómenklatúra szerint, a sót van osztva egy külső és egy belső gömb (kation és anion): az utóbbi áll egy központi atom és ligandumok - atomokból, hogy a központi atom. Cím sót a következőképpen képződik. Kezdetben rögzített nevet belső gömb (anion) a alanyeset, amely ligandumok nevek (előtagokat) és egy központi elem (root) -AT utótagot, és jelzi annak oxidációs foka. Ezután adjuk hozzá a nevét, hogy a név a külső gömb az atomok (kationok) a birtokos esetben.
LiBO3 - trioksoborat (III) lítium-Na2 Cr2 O7 - geptaoksodihromat (VI) NaHSO 4-nátrium - tetraoksosulfat (VI) nátrium-hidrogén-
Nómenklatúra anoxikus-sók
A sók képzésére anoxikus nevek közönséges nevének összeállítása rules binary vegyületek: alkalmazni egy univerzális nómenklatúra szabályait meghatározó numerikus előtagokat vagy Stem jelzi az oxidáció mértékét, a második módszer az előnyös.
Nevek halogenideket állítjuk elő: halogénatom név utótag -ID és kation (NaBr - nátrium-bromid, SF6 - kén-fluorid (VI), vagy a kén-hexafluorid, NB6 I11 - undekaiodid geksaniobiya). Továbbá, ott pszeudohalogén-osztály - sók, amelyek anionjai az galogenidopodobnymi tulajdonságokkal. Nevük vannak kialakítva hasonlóan (Fe (CN) 2 - cianidot, vas (II), AgNCS - tiocianát, ezüst (I)).
Kalkogenidek. tartalmazó, mint az anion kén, szelén és tellúr, az úgynevezett szulfidok, szelenideket és telluridok. Hidrogén-szulfid és szelenid képezhetnek savaddíciós sókat, amelyek úgynevezett rendre gidroselenidami hidroszulfidot és (ZnS - cink-szulfid, SiS2 - szilícium-diszulfid, NaHS - nátrium-hidrogén-szulfiddal). Kettős szulfidok nevezett mutató két kation kötőjellel: (FeCu) S2 - diszulfid, réz-vas.
A fizikai tulajdonságai és szerkezete sók
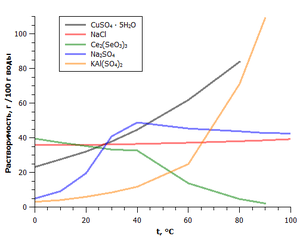
A függőség a oldhatósága néhány só a hőmérséklet
Általában, a sók kristályos anyagok ion kristályrácsban. Például, a kristályok a halogenidek az alkáli- és alkáliföldfémek (nátrium-klorid, CsCI, CaF2) épített anionok található az az elv, a legsűrűbb gömb alakú csomagolás, és a kationok elfoglaló üregek a csomagolásban. Ionos sókristályok is, szintén elkészítettük-maradékok kombinált végtelen anionos csoportokat és háromdimenziós vázszerkezetek kationokkal az üregekben (szilikátok). Ez a struktúra megfelelően tükrözik a fizikai tulajdonságai: vannak magas olvadáspontú, szilárd állapotban szigetelők.
Szintén ismert molekuláris (kovalens) só szerkezete (például, alumínium-klorid AICI 3). Sok sói a természet a kémiai kötések közötti közbenső ionos és kovalens.
Különösen érdekesek azok a ionos folyadékok - sók, amelyek olvadáspontja 100 ° C alatti Továbbá rendellenes olvadási hőmérséklet ionos folyadékok gyakorlatilag nulla gőznyomása és nagy viszkozitású. A speciális tulajdonságait ezeket a sókat magyarázható alacsony szimmetria kation, gyenge kölcsönhatás közötti ionok és a jó töltéseloszlás kation.
Fontos tulajdonsága a sók azok oldhatósága vízben. Ezzel kritériumot szekretálnak oldódó, nehezen oldódó és oldhatatlan sókat.
Mivel a természetben
előállítási módszerek
Vannak különböző sóinak előállítási eljárásait:
- Kölcsönhatás savak fémekkel, alap- és amfoter oxidok / hidroxidok:
H 2 S O 4 + M g ⟶ M g S O 4 + H 2 ↑ + Mg \ longrightarrow MgSO_ \ uparrow >>>
H 2 S O 4 + M g O ⟶ M g S O 4 + H 2O + MgO \ longrightarrow MgSO_O >>>
3 H 2 S O 4 + A l 2 O 3 ⟶ A l 2 (S O 4) 3 + 3 H 2 O + Al_ \ longrightarrow Al _) _ O >>>
- Kölcsönhatása savas oxidok c lúgok, az alap és az amfoter oxidok / hidroxidok:
C egy O + S i O 2 ⟶ C S I O 3 \ longrightarrow CaSiO _ >>
A l 2 O 3 + 3 S O 3 ⟶ A l 2 (S O 4) 3 \ longrightarrow Al _) _ >>
- Kölcsönhatás c savak sói, más sók (alakult, amikor kilép a reakcióterméket):
C C O 3 + 2 H C L ⟶ C a C l 2 + H 2O + C O 2 ↑ + 2 HCI \ longrightarrow CaCl_O + CO_ \ uparrow >>>
C u C l 2 2 + N egy S ⟶ 2 N egy C L + C u S ↓ + Na_S \ longrightarrow 2NaCl + CuS \ downarrow >>>
- A kölcsönhatás egyszerű anyagok:
- Kölcsönhatás bázisokkal nem fémek, például halogénekkel:
C egy (O H) 2 + C l 2 ⟶ C (O C l) C l + H 2 O + Cl_ \ longrightarrow Ca (OCI) CI + H _ >>
Crystal hidrátok általában kristályosításával kapott sók vizes oldatokból, hanem ismert kristály szolvátjai sók, lehulló nemvizes oldószerek (például, CaBr2 · 3 C2 H5 OH).
kémiai tulajdonságok
A kémiai tulajdonságok határozzák meg a tulajdonságait a kationok és anionok bennük.
Sók reagál savakkal és bázisokkal, ha a reakcióterméket kapunk, amely kilép a reakció (csapadékot gáz malodissotsiiruyuschie anyag, mint például víz):
B C L 2 + H 2 S O 4 ⟶ B a S O 4 ↓ + 2 H C l \ longrightarrow BaSO_ \ downarrow + 2 HCI >>>
N a H C O 3 + H C L ⟶ N a C l + H 2 O + C O 2 ↑ + HCI \ longrightarrow NaCl + H_ \ uparrow >>>
N 2 S i O 2 + 3 H C L ⟶ 2 N a C l + H 2 S i O 3 ↓ SiO_ + 2 HCI \ longrightarrow 2NaCl + H_SiO_ \ downarrow >>>
Sók reagál fémekkel, ha a fém marad szabadon fémsók álló fémek az elektrokémiai sorban aktivitás:
C u + H g C l 2 ⟶ C u C l 2 + H g \ longrightarrow CuCI _ >>
Sók kölcsönhatásba egymással, ha a reakció termék kilép a reakciózónában (gáz képződik csapadék vagy víz); beleértve ezek a reakciók mehetnek végbe a változás oxidációs fokú reagensek atomok:
C a C l 2 + N 2 C O 3 ⟶ C a C O 3 ↓ + 2 N egy C L + Na_ \ longrightarrow CaCO_ \ downarrow + 2NaCl >>>
A g N O 3 + N egy C L ⟶ A g C l ↓ + N N O 3 + NaCl \ longrightarrow AgCl \ downarrow + NaNO _ >>
K 2 C r 2 O 7 + 3 N 2 SO 3 + 4 H 2SO 4 ⟶ C R 2 (SO 4) 3 + 3 N 2 SO 4 + K 2SO 4 + 4 H 2O + 3Na_ + K_ + 4H _ >>
Néhány só elbontására hevítve:
C u C O 3 ⟶ C u O + C O 2 ↑ \ longrightarrow CuO + CO_ \ uparrow >>>
4 N H N O 3 ⟶ N 2 O ↑ + 2 H 2 O \ longrightarrow N_O \ uparrow + 2H _ >>
4 N H N O 2 ⟶ N 2 ↑ + 2 H 2 O \ longrightarrow N_ \ uparrow + 2H _ >>
Disszociáció vizes oldatok
teljesen vagy részlegesen disszociál ionokra, amikor oldjuk, sós vízben. Amennyiben a disszociáció történik egyenletesen, a sók erős elektrolitok, vagy - gyenge. Egy példa a tipikus erős elektrolitok lehetnek alkálifémek sói, amelyek léteznek szolvatált ionok oldatban. Annak ellenére, hogy a széles körben elterjedt elmélet, amely azt állítja, hogy a sók disszociált vizes oldatban teljesen, a valóságban a legtöbb sók, van részleges disszociáció, például 0,1 M FeCl3 oldat csak 10% kationjai Fe, és 42% a kationok FeCi, 40% a kationok FeCl2. Kationok FeOH 6% és 2% a kationok Fe (OH) 2.
sók hidrolízis
Bizonyos sók vizes oldatban képesek hidrolízisével. Ez a reakció reverzibilis a gyenge savak sói (Na 2CO 3), vagy gyenge bázisok (CuCI 2), és visszafordíthatatlanul - a gyenge savak sói, és a gyenge bázisok (Al2 S3).